I qPCR-eksperimenter er primerdesign også en svært viktig kobling.Hvorvidt primerne er egnet eller ikke er nært knyttet til om amplifikasjonseffektiviteten når standarden, om de amplifiserte produktene er spesifikke, og om de eksperimentelle resultatene er tilgjengelige.
Så hvordan gjøre qPCR primer spesifisitet bedre?Høy forsterkningseffektivitet?
I dag tar vi deg med til å designe qPCR-primere sammen, og la qPCR-primerdesign bli en effektiv kunnskap i eksperimenter.
Når du designer qPCR-primere, ta vanligvis hensyn til følgende punkter: primere bør designes på tvers av introner så mye som mulig, produktlengden bør være 100-300 bp, Tm-verdien bør være så nær 60°C som mulig, og oppstrøms- og nedstrømsprimerne bør være så nærme som mulig, og slutten av primeren bør være G C, osv.. Vent eller primer.
1. Design av primere som spenner over introner
Når du designer qPCR-primere, kan valg av primere designet på tvers av introner forhindre at gDNA-malen blir amplifisert, og produktene er alle avledet fra amplifikasjonen av cDNA, og eliminerer dermed påvirkningen av gDNA-kontaminering.
2. Primer lengde
Primerlengden er vanligvis mellom 18-30 nt, og lengden på amplifikasjonsproduktet bør kontrolleres mellom 100-300 bp så mye som mulig.
Hvis primeren er for kort, vil det føre til uspesifikk amplifikasjon, og hvis den er for lang, vil den lett danne sekundær struktur (som hårnålsstruktur).Hvis amplifikasjonsproduktet er for langt, er det ikke egnet for reaksjonen av polymerase, noe som vil påvirke effektiviteten av PCR-amplifikasjon.
3. GC-innhold og Tm-verdi
GC-innholdet i primere bør kontrolleres mellom 40 % og 60 %.Hvis den er for høy eller for lav, bidrar den ikke til å sette i gang reaksjonen.GC-innholdet i forover- og reversprimerne bør være nær det samme for å oppnå samme Tm-verdi og annealingstemperatur.
Tm-verdien bør være mellom 55-65°C så langt det er mulig, vanligvis rundt 60°C, og Tm-verdien til oppstrøms og nedstrøms bør være så nært som mulig, helst ikke mer enn 4°C.
4. Unngå å velge A ved 3′-enden av primeren
Når 3′-enden av primeren er feiltilpasset, er det store forskjeller i synteseeffektiviteten til forskjellige baser.Når den siste basen er A, kan den også initiere kjedesyntese selv ved feiltilpasning, og når den siste basen er T When, reduseres effektiviteten av mistilpasningsinduksjonen sterkt.Prøv derfor å unngå å velge A i 3′-enden av primeren, og det er bedre å velge T.
Hvis det er en probeprimer, kan ikke 5′-enden av proben være G, fordi selv når en enkelt G-base er koblet til FAM-fluorescerende reportergruppen, kan G også slukke det fluorescerende signalet som sendes ut av FAM-gruppen, noe som resulterer i falske negative resultater.vises.
5. Grunnfordeling
Fordelingen av de fire basene i primeren er fortrinnsvis tilfeldig, og unngår mer enn 3 påfølgende G eller C i 3'-enden, og mer enn 3 påfølgendeG eller C er enkle å generere sammenkobling i den GC-rike sekvensregionen.
6. Primerdesignområdet bør unngå komplekse sekundære strukturer.
Den sekundære strukturen dannet av enkeltstrengen til amplifikasjonsproduktet vil påvirke den jevne fremdriften av PCR.Ved å forutsi om det er en sekundær struktur i målsekvensen på forhånd, prøv å unngå denne regionen i utformingen av primere.
7. Primerne i seg selv og mellom primerne bør prøve å unngå påfølgende komplementære baser.
Det kan ikke være noen fortløpende 4 baser komplementaritet mellom selve primeren og primeren.Primeren i seg selv bør ikke ha en komplementær sekvens, ellers vil den folde seg selv for å danne en hårnålsstruktur, noe som vil påvirke annealingskombinasjonen av primeren og malen.
Komplementære sekvenser kan ikke eksistere mellom oppstrøms og nedstrøms primere.Komplementaritet mellom primere vil produsere primerdimerer, som vil redusere PCR-effektiviteten og til og med påvirke kvantitativ nøyaktighet.Hvis primer-dimer- og hårnålsstrukturene er uunngåelige, bør ikke △G-verdien være for høy (bør være mindre enn 4,5 kcal/mol).
8. Primerne forsterker det målspesifikke produktet.
Det endelige målet med qPCR-deteksjon er å forstå overfloden av målgenet.Hvis ikke-spesifikk amplifikasjon forekommer, vil kvantifiseringen være unøyaktig.Derfor, etter at primerne er designet, må de testes av BLAST, og spesifisiteten til produktene sammenlignes i sekvensdatabasen.
Deretter tar vi det humane GAS6 (Growth arrest specific 6) genet som et eksempel for å designe qPCR-primere.
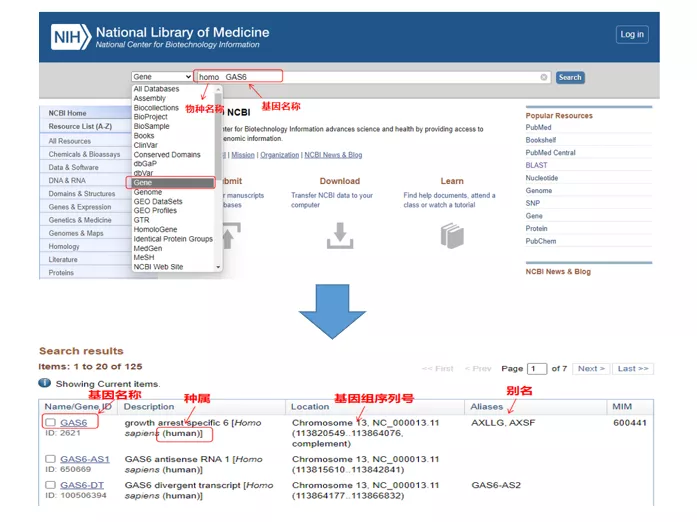
01 spørringsgen
Homo GAS6gjennom NCBI.Her bør vi være oppmerksom på å sammenligne gennavnet og artene for å sikre at de er konsistente.
 02 Finn gensekvensen
02 Finn gensekvensen
(1) Hvis målsekvensen er genomisk DNA, velg den første, som er den genomiske DNA-sekvensen til genet.
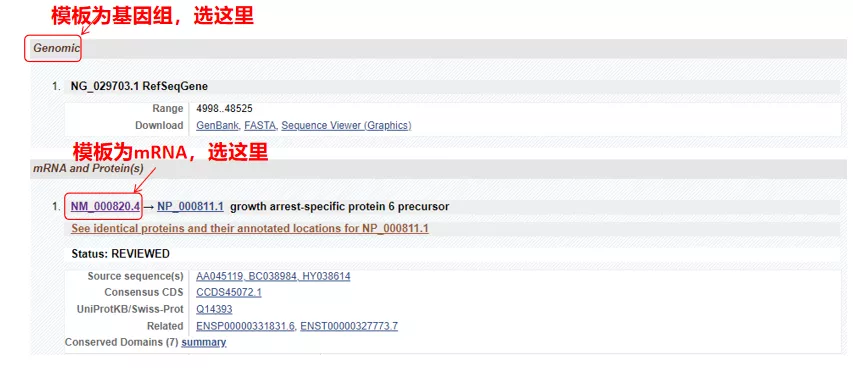 (2) Hvis målsekvensen er mRNA, velg den andre.Etter inntasting klikker du på "CDS" i tabellen nedenfor.Den brune bakgrunnssekvensen er den kodende sekvensen til genet.
(2) Hvis målsekvensen er mRNA, velg den andre.Etter inntasting klikker du på "CDS" i tabellen nedenfor.Den brune bakgrunnssekvensen er den kodende sekvensen til genet.
 03 Design primere
03 Design primere
Gå inn i Primer-BLAST-grensesnittet
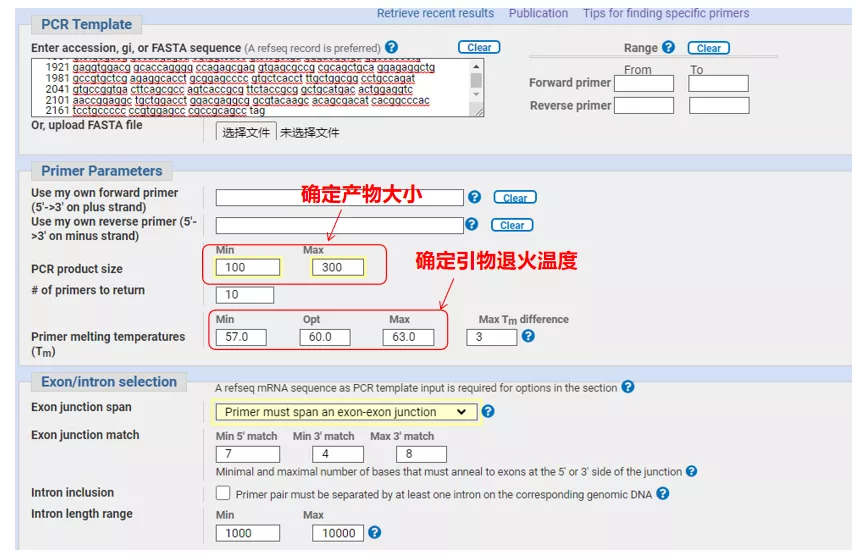
 Skriv inn gensekvensnummeret eller sekvensen i Fasta-format oppe til venstre, og fyll inn relevante parametere.
Skriv inn gensekvensnummeret eller sekvensen i Fasta-format oppe til venstre, og fyll inn relevante parametere.
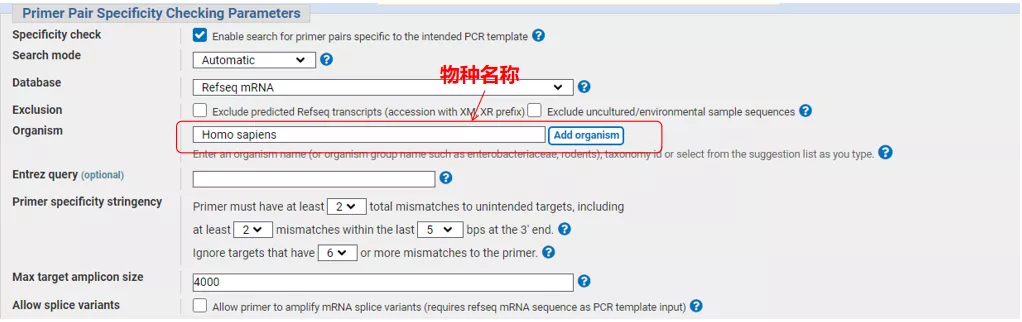
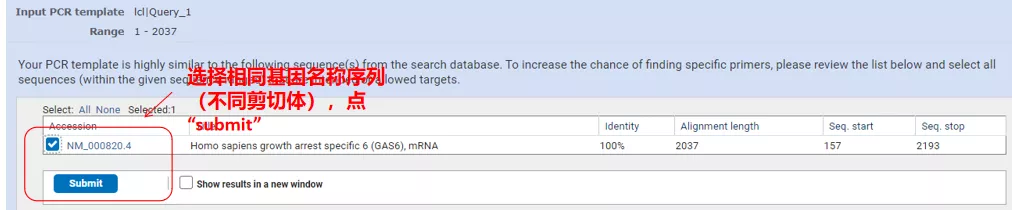
Klikk på "Get primers" og NCBI vil dukke opp for å fortelle deg at et slikt parametervalg vil bli forsterket til andre spleisevarianter.Vi kan sjekke de forskjellige skjøtevariantene og sende dem inn for å få riktig primerpar (som vist i figuren nedenfor).Denne prosessen kan ta flere titalls sekunder å kjøre.
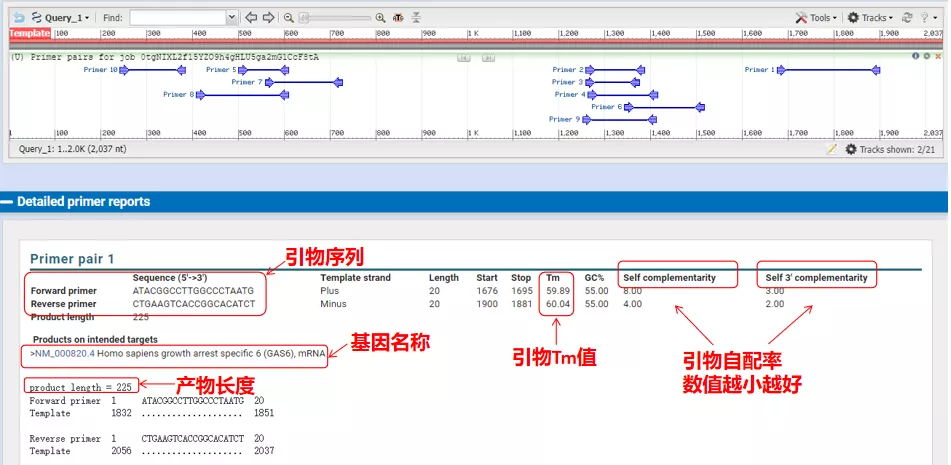 Utglødningstemperaturene til disse primerparene er rundt 60°C.I henhold til formålet med forsøket, velg primere med moderat lengde, god spesifisitet og mindre selvkomplementering av primerne til forsøket, og suksessraten er ganske høy!
Utglødningstemperaturene til disse primerparene er rundt 60°C.I henhold til formålet med forsøket, velg primere med moderat lengde, god spesifisitet og mindre selvkomplementering av primerne til forsøket, og suksessraten er ganske høy!
04Primerspesifisitetsverifisering
Faktisk, i tillegg til å designe primere, kan Primer-Blast også evaluere primerne vi har designet selv.Gå tilbake til primerdesignsiden, skriv inn oppstrøms- og nedstrømsprimerne vi designet, og andre parametere vil ikke bli justert.Etter innsending kan du se om primerparet også finnes på andre gener.Hvis alle av dem vises på genet vi ønsker å amplifisere, noe som indikerer at spesifisiteten til dette primerparet er stor!(For eksempel er dette det eneste resultatet av primer-spørringen!)
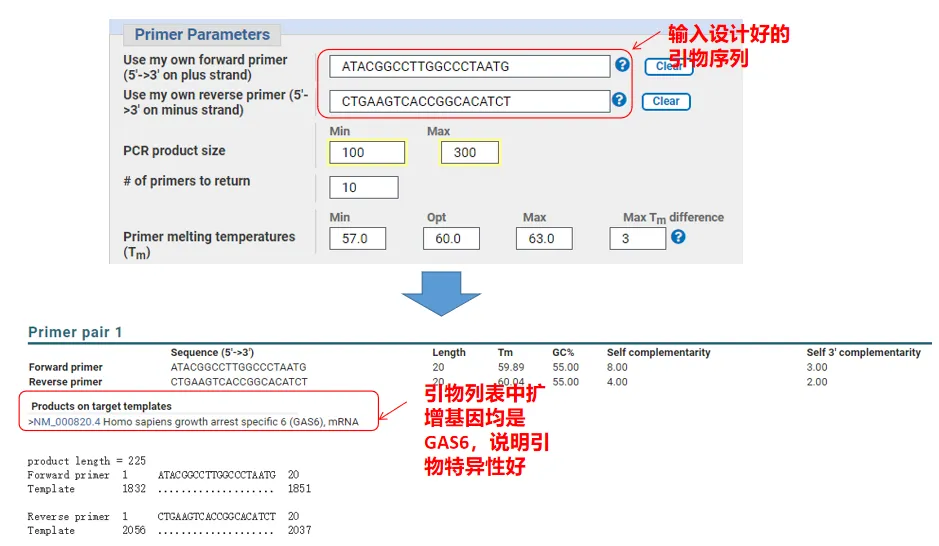
05 Primer kvalitetsvurdering
Hva slags primer er den "perfekte" primeren som kombinerer "amplifikasjonseffektivitet opp til standard", "amplifiserte produktegenskaper" og "pålitelige eksperimentelle resultater"?
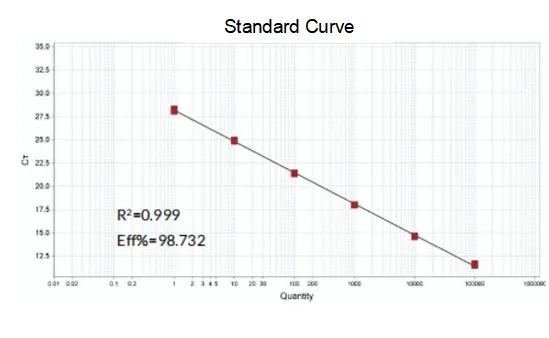 Forsterkningseffektivitet
Forsterkningseffektivitet
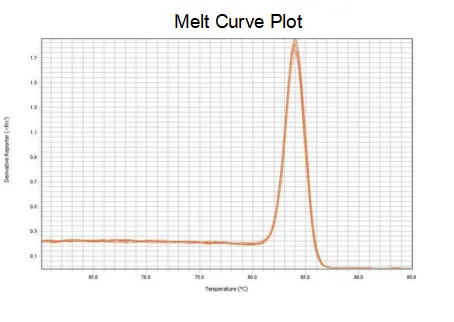 smeltekurve
smeltekurve
Amplifikasjonseffektiviteten til primerne når 90%-110%, noe som betyr at amplifikasjonseffektiviteten er god, og smeltekurven har en enkelt topp og vanligvis Tm>80°C, noe som betyr at amplifikasjonsspesifisiteten er god.
Relaterte produkter:
Real Time PCR Easy–SYBR GREEN I
Sanntids PCR Easy-Taqman
Innleggstid: 10. februar 2023








