Ⅰ. Øk reaksjonssystemets følsomhet:
1. Separat RNA av høy kvalitet:
Vellykket cDNA-syntese kommer fra RNA av høy kvalitet.RNA av høy kvalitet bør sikre minst en total lengre og inneholder ikke hemmere som ikke inneholder registreringsenzymer, som EDTA eller SDS.Kvaliteten på RNA bestemmer den maksimale verdien av sekvensinformasjonen du kan transkribere til cDNA.Den generelle RNA-rensemetoden er en trinnvis metode for bruk av isoocyanat/acidofenol.For å forhindre forurensning av RNase, krever RNA separert fra en prøve rik på RNase (som bukspyttkjertelen) lagring av formaldehyd for å redde RNA av høy kvalitet, som er enda mer for langtidslagring.RNA ekstrahert fra rotteleveren ble i utgangspunktet degradert etter en ukes lagring i vann, mens RNA ekstrahert fra rottemilten holdt seg stabil etter tre års lagring i vann.I tillegg er transkripsjoner større enn 4kb mer følsomme for spor-RNase-nedbrytning enn små transkripsjoner.For å øke stabiliteten til lagrings-RNA-prøven, kan RNA oppløses i et methalmamin av ion, og lagres -70 °C.Tylid som brukes til å redde RNA må ikke inneholde en annen gjenstand som bryter ned RNA.RNA, som er avledet fra bukspyttkjertelen, kan lagres i methalmamin i minst ett år.Når du er klar til å bruke RNA, kan du bruke følgende metoder for å utfelle RNA: tilsett NaCl til 0,2 m og 4 ganger volumet av etanol, plasser romtemperatur i 3-5 minutter og 10 000 × g sentrifugal i 5 minutter.
2. Bruk revers transkriptase uten RNaseH-aktivitet (RNaseH-):
RNase-hemmere legges ofte til revers transkripsjonsreaksjoner for å øke lengden og utbyttet av cDNA-syntese.RNase-hemmer tilsettes i den første kjedesyntesereaksjonen i nærvær av buffere og reduksjonsmidler som DTT fordi pre-cDNA-synteseprosessen denaturerer inhibitoren, og frigjør dermed bundne RNaser som bryter ned RNA.Protein RNase-hemmer forhindrer bare nedbrytning av RNA av RNase A, B, C, og forhindrer ikke RNaser på huden, så man bør passe på å ikke introdusere RNaser fra fingrene til tross for bruk av disse inhibitorene.
Revers transkriptase katalyserer omdannelsen av RNA til cDNA.Både M-MLV og AMV har endogen RNaseH-aktivitet i tillegg til sin egen polymeraseaktivitet.RNaseH-aktivitet konkurrerer med polymeraseaktivitet for heterozygote tråder dannet mellom RNA-templater og DNA-primere eller cDNA-forlengelsestråder, og bryter ned RNA: RNA-tråder i DNA-komplekser.RNA-maler degradert av RNaseH-aktivitet kan ikke lenger brukes som effektive substrater for cDNA-syntese, noe som reduserer utbyttet og lengden av cDNA-syntesen.Å eliminere eller i stor grad redusere RNaseH-aktiviteten til revers transkriptase ville være til stor fordel.
SuperScriptⅡ revers transkriptase, MMLV revers transkriptase av RNaseH- og thermoScript revers transkriptase, AMV av RNaseH- ga mer cDNA i full lengde enn MMLV og AMV.RT-PCR-sensitivitet påvirkes av mengden cDNA som syntetiseres.ThermoScript er mye mer følsomt enn AMV.Størrelsen på RT-PCR-produkter er begrenset av revers transkriptases evne til å syntetisere cDNA, spesielt ved kloning av større Cdnaer.Sammenlignet med MMLV, økte SuperScripⅡ betydelig utbyttet av lange RT-PCR-produkter.RNaseH-s revers transkriptase øker også termisk stabilitet, slik at reaksjonen kan utføres ved temperaturer høyere enn normalt på 37-42 ℃.Under de foreslåtte syntesebetingelsene ble oligo(dT)-primere og 10μCi [alfa-p]dCTP brukt.Den totale produksjonen av den første kjeden ble beregnet ved bruk av TCA-utfellingsmetoden.Full-lengde cDNA ble analysert ved bruk av størrelsessortert stripfjerning og telling i en alkalisk agarosegel.
3. Øk varmekonserveringstemperaturen for omvendt transkripsjon:
Høyere holdetemperatur bidrar til å åpne den sekundære strukturen til RNA og øke utbyttet av reaksjonen.For de fleste RNA-maler eliminerer man de fleste sekundære strukturer ved å holde RNA og primeren ved 65 °C uten buffer eller salt og deretter avkjøle dem raskt på is og tillater primerne å binde seg.Imidlertid har noen maler fortsatt sekundær struktur, selv etter termisk denaturering.Amplifisering av disse vanskelige malene kan utføres ved å bruke ThermoScript revers transkriptase og ved å plassere revers transkriptasereaksjonen ved høyere temperaturer for å forbedre amplifikasjonen.Høyere holdetemperaturer kan også øke spesifisiteten, spesielt når cDNA-syntese utføres ved bruk av genspesifikke primere (GSPS) (se kapittel 3).Hvis du bruker GSP, sørg for at Tm-verdien til primeren er den samme som forventet holdetemperatur.Ikke bruk oligo(dT) og tilfeldige primere over 60 ℃.Tilfeldige primere må holdes ved 25 ℃ i 10 minutter før de økes til 60 ℃.I tillegg til å bruke høyere revers transkripsjonstemperaturer, kan spesifisiteten forbedres ved direkte å overføre RNA/primerblandingen fra 65 ℃ denatureringstemperaturen til revers transkripsjonsholdetemperaturen og tilsette en forvarmet 2× reaksjonsblanding (cDNA termisk initieringssyntese).Denne tilnærmingen bidrar til å forhindre den intermolekylære baseparingen som oppstår ved lavere temperaturer.Bruk av et PCR-instrument forenkler de mange temperaturbryterne som kreves for RT-PCR.
Den varmestabiliserte polymerase fungerer som DNA-polymerase i nærvær av Mg2+ og RNA-polymerase i nærvær av Mn2+.Den kan holde varmen på opptil 65 ℃.Tilstedeværelsen av Mn2+ under PCR reduserer imidlertid troskap, noe som gjør Tth-polymerase mindre egnet for høypresisjonsforsterkning, slik som cDNA-kloning.I tillegg er Tth mindre effektiv ved revers transkripsjon, noe som reduserer følsomheten, og siden et enkelt enzym kan utføre revers transkripsjon og PCR, kan ikke kontrollreaksjoner uten revers transkripsjon brukes til å skille amplifiserte cDNA-produkter fra forurenset genomisk DNA.
4. Tilsetningsstoff som fremmer omvendt transkripsjon:
Tilsetning av tilsetningsstoffer, inkludert glyserin og DMSO, til den første kjedesyntesereaksjonen kan redusere stabiliteten til nukleinsyredobbeltstrengen og avvikle RNA-sekundærstrukturen.Opptil 20 % glyserin eller 10 % DMSO kan tilsettes uten å påvirke aktiviteten til SuperScriptⅡ eller MMLV.AMV kan også tolerere opptil 20 % glyserol uten å redusere aktiviteten.For å maksimere følsomheten til RT-PCR i SuperScriptⅡ revers transkripsjonsreaksjon, kan 10 % glyserol tilsettes og isoleres ved 45 ℃.Hvis 1/10 av retrotranskripsjonsreaksjonsproduktet tilsettes PCR, er konsentrasjonen av glyserol i amplifikasjonsreaksjonen 0,4 %, noe som ikke er nok til å hemme PCR.
5. RNaseH-behandling:
Sensitiviteten kan forbedres ved å behandle cDNA-syntesereaksjoner med RNaseH før PCR.For noen maler antas det at RNA i cDNA-syntesereaksjonen forhindrer binding av amplifiserte produkter, i så fall kan RNaseH-behandlingen øke følsomheten.Generelt er RNaseH-behandling nødvendig for amplifikasjon av en relativt lang cDNA-målmal i full lengde, slik som tuberøs scherosisⅡ med lav kopi.For denne vanskelige malen forbedret RNaseH signalet generert av cDNA syntetisert av SuperScriptⅡ eller AMV.For de fleste RT-PCR-reaksjoner er RNaseH-behandlingen valgfri fordi det 95 ℃ isolerte PCR-denatureringstrinnet typisk hydrolyserer RNA fra RNA: DNA-komplekset.
6. Forbedrede metoder for å oppdage små mengder RNA:
RT-PCR er spesielt utfordrende når bare små mengder RNA er tilgjengelig.Tilsetning av glykogen som bærer under RNA-separasjon bidrar til å øke utbyttet av små prøver.Et RNase-fritt glykogen kan tilsettes samtidig med Trizol.Glykogen er vannløselig og kan forbli i vannfasen med RNA for å hjelpe til med påfølgende nedbør.Den anbefalte konsentrasjonen av RNase-fritt glykogen er 250 μg/ml for prøver mindre enn 50 mg vev eller 106 dyrkede celler.
Tilsetning av acetylert BSA for å reversere transkripsjonsreaksjoner ved bruk av SuperScriptⅡ kan øke følsomheten, og for små mengder RNA kan reduksjon av mengden SuperScriptⅡ og tilsetning av 40 enheter RNaseOut nukleasehemmer forbedre deteksjonsnivået.Hvis glykogen brukes i RNA-separasjon, anbefales fortsatt tilsetning av BSA- eller RNase-hemmere for å reversere transkripsjonsreaksjoner ved bruk av SuperScriptⅡ.
Ⅱ. Øk spesifisiteten til RT-PCR
1. cNDA syntese:
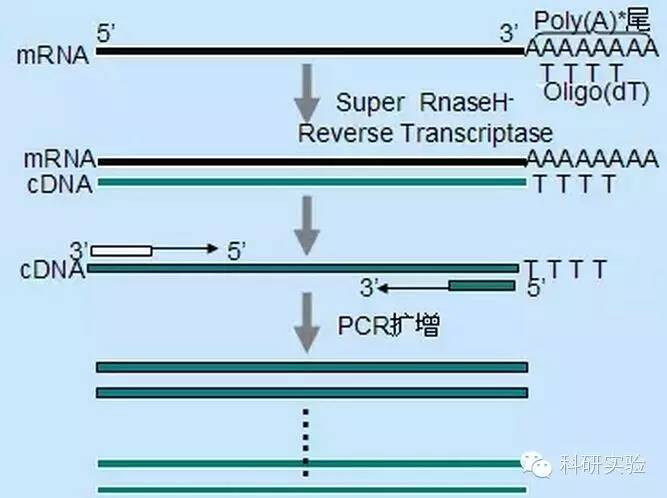
Tre forskjellige metoder kan brukes for å initiere første streng cDNA-syntese, og den relative spesifisiteten til hver metode påvirker mengden og typen cDNA som syntetiseres.
Tilfeldig primermetode er den minst spesifikke av de tre metodene.Primere anneales på flere steder gjennom transkripsjonen for å produsere kort, delvis lengde cDNA.Denne metoden brukes ofte for å oppnå 5′-terminale sekvenser og cDNA fra RNA-maler med sekundære strukturelle regioner eller med terminerende steder som revers transkriptase ikke kan replikere.For å oppnå det lengste cDNA, må forholdet mellom primere og RNA i hver RNA-prøve bestemmes empirisk.Startkonsentrasjonen av tilfeldige primere varierer fra 50 til 250 ng per 20 μl reaksjonssystem.Fordi cDNA syntetisert fra totalt RNA ved bruk av tilfeldige primere hovedsakelig er ribosomalt RNA, velges generelt poly(A)+RNA som mal.
Oligo(dT)-initiering er mer spesifikk enn tilfeldige primere.Den hybridiserer med poly(A)-halen som finnes i 3'-enden av mRNA i de fleste eukaryote celler.Fordi poly(A)+RNA er omtrent 1 % til 2 % av totalt RNA, er mengden og kompleksiteten til cDNA mye mindre enn hvis tilfeldige primere ble brukt.På grunn av sin høye spesifisitet krever oligo(dT) generelt ikke optimalisering for RNA til primer-forhold og poly(A)+-seleksjon.Det anbefales å bruke 0,5 μg oligo(dT) per 20 μl reaksjonssystem.oligo(dT)12-18 er egnet for de fleste RT-PCR.ThermoScript RT-PCR System gir oligo(dT)20 på grunn av sin gode termiske stabilitet og er egnet for høyere holdetemperaturer.
Genspesifikke primere (GSP) er de beste spesifikke primerne for revers transkripsjonstrinnet.GSP er et antisense-oligonukleosid som spesifikt kan hybridisere med RNA-destinasjonssekvenser, i stedet for å anneale alle RNA-er som tilfeldige primere eller oligo(dT).Reglene som brukes til å designe PCR-primere gjelder også for utformingen av revers transkripsjonsreaksjon GSP.GSP kan være den samme sekvensen som amplifikasjonsprimeren annealet på slutten av mRNA3′, eller GSP kan utformes for å anneales nedstrøms med revers amplifikasjonsprimeren.For noen amplifiserte objekter er det nødvendig å designe mer enn én antisense-primer for vellykket RT-PCR fordi den sekundære strukturen til mål-RNA-en kan forhindre at primeren binder seg.Det er foreslått å bruke 1 pmol antisense GSP i det første kjedesyntesereaksjonssystemet på 20 μl.
2. Øk varmekonserveringstemperaturen for omvendt transkripsjon:
For å dra full nytte av GSP-spesifisitet, bør revers transkriptase med høy termisk stabilitet brukes.Varmestabil revers transkriptase kan isoleres ved høyere temperaturer for å øke reaksjonens strenghet.For eksempel, hvis en GSP er annealet ved 55°C, blir ikke spesifisiteten til GSP utnyttet fullt ut hvis revers transkripsjon utføres ved 37°C med lav rigor ved bruk av AMV eller M-MLV.SuperScripⅡ og ThermoScript kan imidlertid reagere ved 50 ℃ eller høyere, noe som eliminerer uspesifikke produkter produsert ved lavere temperaturer.For maksimal spesifisitet kan RNA/primerblandingen overføres direkte fra 65 ℃ denatureringstemperaturen til revers transkripsjonsholdetemperaturen med tilsetning av en forvarmet 2 x reaksjonsblanding (termisk initiering av cDNA-syntese).Dette bidrar til å forhindre baseparing mellom molekyler ved lave temperaturer.Bruk av et PCR-instrument forenkler de mange temperaturovergangene som kreves for RT-PCR.
3. Reduser genomisk DNA-kontaminering:
En potensiell vanskelighet med RT-PCR er at RNA forurenser genomisk DNA.Bruken av bedre RNA-separasjonsmetoder, som Trizol Reagent, reduserer genomisk DNA-kontaminering i RNA-preparater.For å unngå produkter produsert fra genomisk DNA, kan RNA behandles med amplifikasjonsgrad DnasⅠ for å fjerne kontaminert DNA før revers transkripsjon.Prøvene ble holdt ved 65 ℃ i 2,0 mM EDTA i 10 minutter for å avslutte DNaseⅠ-fordøyelsen.EDTA chelaterer magnesiumioner for å forhindre den magnesiumionavhengige RNA-hydrolyse som skjer ved høye temperaturer.
For å skille amplifisert cDNA fra genom-DNA-amplifikasjonsproduktet, kan primere som annealer separat med det separerte eksonet designes.PCR-produkter avledet fra cDNA vil være kortere enn de avledet fra kontaminert genomisk DNA.Et kontrollert eksperiment uten revers transkripsjon utføres også på hver RNA-mal for å bestemme om et gitt fragment er fra genomisk DNA eller cDNA.PCR-produkter oppnådd i fravær av revers transkripsjon er avledet fra genomet.
Relatert produkt
-Et-trinns-settet gjør det mulig å utføre revers transkripsjon og PCR i samme rør.Den trenger bare å legge til mal-RNA, spesifikke PCR-primere og RNase-fri ddH2O.
- Sanntids kvantitativ analyse av RNA kan utføres raskt og nøyaktig.
- Settet bruker et unikt Foregene revers transkripsjonsreagens og Foregene HotStar Taq DNA-polymerase kombinert med et unikt reaksjonssystem for å effektivt forbedre amplifikasjonseffektiviteten og spesifisiteten til reaksjonen.
-Det optimerte reaksjonssystemet gjør at reaksjonen har høyere deteksjonsfølsomhet, sterkere termisk stabilitet og bedre toleranse.
RT Easy II(Med GDNase) Master Premix for første-strengs CDNA-syntese for sanntids-PCR med GDNase
-Effektiv evne til å fjerne gDNA, som kan fjerne gDNA i malen innen 2 minutter.
-Effektivt omvendt transkripsjonssystem, det tar bare 15 minutter å fullføre syntesen av den første strengen cDNA.
-Komplekse maler: maler med høyt GC-innhold og kompleks sekundærstruktur kan også reverseres med høy effektivitet.
-Høysensitivt omvendt transkripsjonssystem, pg-nivå maler kan også få høykvalitets cDNA.
-Revers transkripsjonssystemet har høy termisk stabilitet, den optimale reaksjonstemperaturen er 42 ℃, og det har fortsatt god revers transkripsjonsytelse ved 50 ℃.
Innleggstid: Mar-07-2023