PCR (polymerasekjedereaksjon) er en av in vitro DNA-amplifikasjonsteknologiene, med en historie på mer enn 30 år.
PCR-teknologien ble utviklet av Kary Mullis fra Cetus, USA i 1983. Mullis søkte om et PCR-patent i 1985 og publiserte den første akademiske PCR-oppgaven om vitenskap samme år.Mullis ble tildelt Nobelprisen i kjemi i 1993 for sitt arbeid.
Grunnleggende prinsipper for PCR
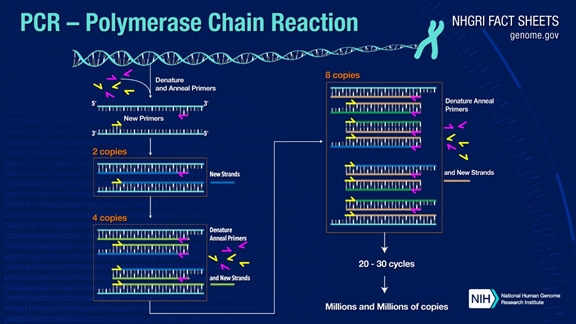
PCR kan amplifisere mål-DNA-fragmenter med mer enn én million ganger.Prinsippet er under katalyse av DNA-polymerase, ved å bruke foreldretråd-DNA som mal og spesifikk primer som utgangspunkt for forlengelse.Det replikeres in vitro gjennom trinn som denaturering, annealing og forlengelse.Prosessen med datterstreng-DNA som er komplementær til stamtråd-DNA.
Standard PCR-prosessen er delt inn i tre trinn:
1.Denaturering: Bruk høy temperatur for å skille DNA-dobbeltråder.Hydrogenbindingen mellom DNA-dobbeltråder brytes ved høy temperatur (93-98 ℃).
2. Annealing: Etter at det dobbelttrådete DNA er separert, senker du temperaturen slik at primeren kan binde seg til det enkelttrådede DNA.
3. Forlengelse: DNA-polymerasen begynner å syntetisere komplementære tråder langs DNA-trådene fra primerne bundet når temperaturen senkes.Når utvidelsen er fullført, fullføres en syklus, og antallet DNA-fragmenter dobles
Ved å gjengjelde disse tre trinnene 25-35 ganger, vil antallet DNA-fragmenter øke eksponentielt.
Oppfinnsomheten med PCR er at forskjellige primere kan designes for forskjellige målgener, slik at målgenfragmenter kan amplifiseres i løpet av kort tid.
Så langt kan PCR deles inn i tre kategorier, nemlig ordinær PCR, fluorescerende kvantitativ PCR og digital PCR.
Den første generasjonen av vanlig PCR
Bruk et vanlig PCR-amplifikasjonsinstrument for å amplifisere målgenet, og bruk deretter agarosegelelektroforese for å oppdage produktet, kun kvalitativ analyse kan gjøres.
De viktigste ulempene med første generasjons PCR:
1. Utsatt for uspesifikk amplifikasjon og falske positive resultater.
2. Deteksjonen tar lang tid og operasjonen er tungvint.
3. Bare kvalitativ test kan gjøres
Andre generasjons sanntids PCR
Real-Time PCR, også kjent som qPCR, bruker fluorescerende prober som kan indikere fremdriften til reaksjonssystemet, og overvåker akkumulering av amplifiserte produkter gjennom akkumulering av fluorescerende signaler, og bedømmer resultatene gjennom fluorescenskurven.Den kan kvantifiseres ved hjelp av Cq-verdi og standardkurve.
Fordi qPCR-teknologien utføres i et lukket system, reduseres sannsynligheten for kontaminering, og fluorescenssignalet kan overvåkes for kvantitativ deteksjon, så det er den mest brukte i klinisk praksis og har blitt den dominerende teknologien innen PCR.
De fluorescerende stoffene som brukes i sanntids fluorescerende kvantitativ PCR kan deles inn i: TaqMan fluorescerende probe, molekylære beacons og fluorescerende fargestoff.
1) TaqMan fluorescerende sonde:
Under PCR-amplifisering tilsettes en spesifikk fluorescerende probe mens du legger til et par primer.Proben er et oligonukleotid, og begge ender er merket med en reporter-fluorescerende gruppe og en quencher-fluorescerende gruppe.
Når proben er intakt, absorberes det fluorescerende signalet som sendes ut av reportergruppen av quenching-gruppen;under PCR-amplifisering spalter og bryter 5'-3'-eksonukleaseaktiviteten til Taq-enzymet proben, noe som gjør reporteren til fluorescerende gruppe og quencher. Den fluorescerende gruppen separeres, slik at fluorescensovervåkingssystemet kan motta fluorescenssignalet, det vil si hver gang en DNA-tråd blir akkumulert for fluorescerende molekyler og fluoreserer. cence-signalet er fullstendig synkronisert med dannelsen av PCR-produktet.
2) SYBR fluorescerende fargestoff:
I PCR-reaksjonssystemet tilsettes et overskudd av SYBR fluorescerende fargestoff.Etter at SYBR-fluorescerende fargestoff er ikke-spesifikt inkorporert i DNA-dobbeltstrengen, sender det ut et fluorescerende signal.SYBR-fargestoffmolekylet som ikke er inkorporert i kjeden vil ikke sende ut noe fluorescerende signal, og dermed sikre det fluorescerende signalet Økningen i PCR-produkter er fullstendig synkronisert med økningen i PCR-produkter.SYBR binder seg kun til dobbelttrådet DNA, så smeltekurven kan brukes til å bestemme om PCR-reaksjonen er spesifikk.
3) Molekylært fyrtårn:
Det er en stilkløkke dobbeltmerket oligonukleotidprobe som danner en hårnålsstruktur på omtrent 8 baser i de 5 og 3 endene.Nukleinsyresekvensene i begge ender er komplementært paret, noe som fører til at den fluorescerende gruppen og den slokkende gruppen er tette.Lukk, ingen fluorescens vil bli produsert.
Etter at PCR-produktet er generert, under annealingsprosessen, blir den midtre delen av det molekylære beacon paret med en spesifikk DNA-sekvens, og det fluorescerende genet separeres fra quencher-genet for å produsere fluorescens.
De viktigste ulempene med andre generasjons PCR:
Følsomheten mangler fortsatt, og deteksjonen av prøver med lite kopier er unøyaktig.
Det er påvirkning av bakgrunnsverdien, og resultatet er mottakelig for forstyrrelser.
Når det er PCR-hemmere i reaksjonssystemet, er deteksjonsresultatene følsomme for interferens.
Tredje generasjons digital PCR
Digital PCR (DigitalPCR, dPCR, Dig-PCR) beregner kopitallet til målsekvensen gjennom endepunktdeteksjon, og kan utføre nøyaktig absolutt kvantitativ deteksjon uten å bruke interne kontroller og standardkurver.
Digital PCR bruker endepunktdeteksjon og er ikke avhengig av Ct-verdien (syklusterskel), så den digitale PCR-reaksjonen påvirkes mindre av amplifikasjonseffektiviteten, og toleransen for PCR-reaksjonshemmere er forbedret, med høy nøyaktighet og reproduserbarhet.
På grunn av egenskapene til høy følsomhet og høy nøyaktighet, blir det ikke lett forstyrret av PCR-reaksjonshemmere, og det kan oppnå ekte absolutt kvantifisering uten standardprodukter, som har blitt et forsknings- og applikasjonshotspot.
I henhold til de forskjellige formene for reaksjonsenheten kan den deles inn i tre hovedtyper: mikrofluid-, chip- og dråpesystemer.
1) Mikrofluidisk digital PCR, mdPCR:
Basert på mikrofluidteknologien separeres DNA-malen.Den mikrofluidiske teknologien kan realisere prøven nano-oppgradering eller generering av mindre dråper, men dråpene trenger en spesiell adsorpsjonsmetode og deretter kombinert med PCR-reaksjonssystemet.mdPCR har gradvis blitt tatt i bruk ved å erstatte andre metoder.
2) Dråpebasert digital PCR, ddPCR:
Bruk vann-i-olje-dråpegenereringsteknologi for å behandle prøven til dråper, og del opp reaksjonssystemet som inneholder nukleinsyremolekyler i tusenvis av nanoskala dråper, som hver ikke inneholder nukleinsyremålmolekylet som skal detekteres, eller inneholder ett til flere nukleinsyremålmolekyler som skal testes.
3) Chip-basert digital PCR, cdPCR:
Bruk den integrerte væskebaneteknologien til å gravere mange mikrorør og mikrohulrom på silisiumskiver eller kvartsglass, og kontroller flyten av løsningen gjennom forskjellige kontrollventiler, og del prøvevæsken i nanometer av samme størrelse i reaksjonsbrønnene for digital PCR-reaksjon for å oppnå absolutt kvantifisering.
De viktigste ulempene med tredje generasjons PCR:
Utstyret og reagensene er dyre.
Malkvalitetskravene er høye.Hvis malmengden overstiger mikrosystemmengden, vil den være umulig å kvantifisere, og hvis den er for liten, vil kvantifiseringsnøyaktigheten reduseres.
Falske positive kan også genereres når det er ikke-spesifikk forsterkning.
Innleggstid: 30. juli 2021