Å verifisere ytelsen til primere og prober i det tidlige stadiet av PCR-reagenser og bestemme de mest egnede reaksjonsforholdene er forutsetningene for å sikre jevn fremdrift av formelle eksperimenter.
Så hvordan må vi bekrefte primerproben på et tidlig stadium?
Hovedindikatorene er baseline, amplifikasjonskurve, ct-verdi, amplifikasjonseffektivitet, lavkonsentrasjonsprøvedeteksjon, CV, etc.
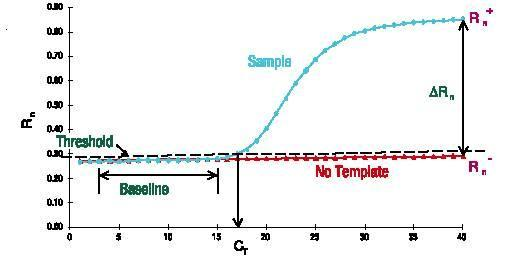
Grunnlinje
Grunnlinjen er den horisontale linjen i PCR-amplifikasjonskurven.I de første par syklusene av PCR-amplifikasjonsreaksjonen endres ikke fluorescenssignalet mye og danner en rett linje.Denne rette linjen er grunnlinjen.
Når du screener PCR-primerprober, vær oppmerksom på om grunnlinjen er nivå.Renheten til primerprobekonsentrasjonen vil påvirke grunnlinjen, for eksempel få grunnlinjen til å stige eller falle.Grunnlinjen er også en veldig intuitiv indikator.
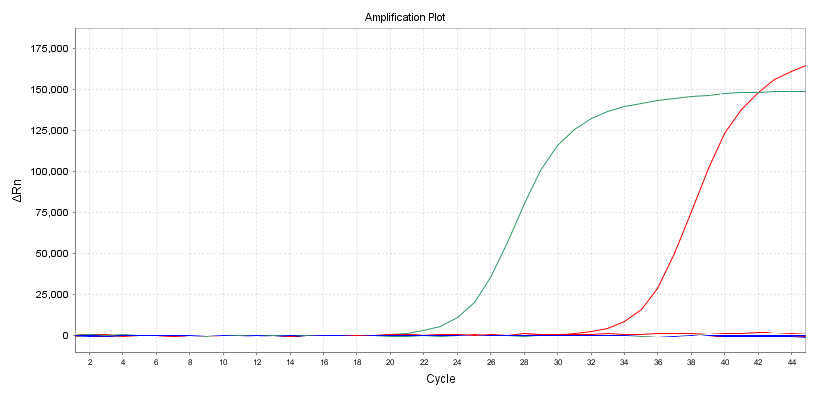
Amplifikasjonskurve
En annen intuitiv indikator er formen på forsterkningskurven.Det er best å ha en S-formet kurve for å unngå sekundær forsterkning eller andre unormale forsterkningskurver.
Ct-verdi
Antallet sykluser som tilsvarer vendepunktet fra grunnlinjen til eksponentiell vekst er Ct-verdien.
For samme prøve resulterer forskjellige primerprober i forskjellige amplifikasjonskurver, og den tilsvarende Ct-verdien vil bli påvirket av amplifikasjonseffektiviteten og interferensgraden.I teorien, jo mindre Ct-verdien til primerproben vi velger, jo bedre.
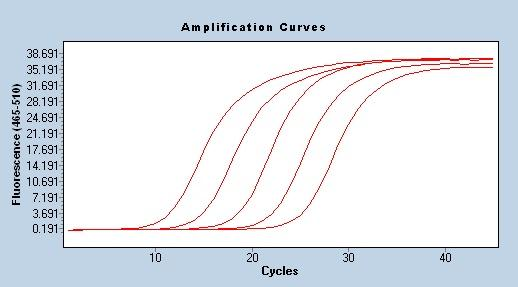
Forsterkningseffektivitet
En av de mest pålitelige og stabile metodene for å evaluere PCR-amplifikasjonseffektiviteten er standardkurven, som også er allment anerkjent av forskere.Metoden innebærer å lage en serie prøver for å kontrollere det relative antallet målmaler.Disse prøvene lages vanligvis ved seriefortynninger av konsentrerte stamløsninger, den mest brukte er 10 gangers fortynning.Ved å bruke en serie fortynnede prøver, bruke standard qPCR-program for å amplifisere for å oppnå Cq-verdien, og til slutt tegne en standardkurve i henhold til konsentrasjonen av hver prøve og den tilsvarende Cq-verdien for å oppnå den lineære ligningen Cq= -klgX0+b, og amplifikasjonseffektiviteten E=10(-1 /k)-1.Ved bruk av qPCR for kvantitativ analyse, kreves det at amplifikasjonseffektiviteten er i området 90 %-110 % (3,6>k>3,1).
Deteksjon av prøver med lav konsentrasjon
Når prøvekonsentrasjonen er lav, er deteksjonshastighetene til forskjellige primerprober forskjellige.Vi velger ut 20 prøver med lav konsentrasjon for å replikere, og primer-probe-systemet med høyest deteksjonshastighet er det beste.
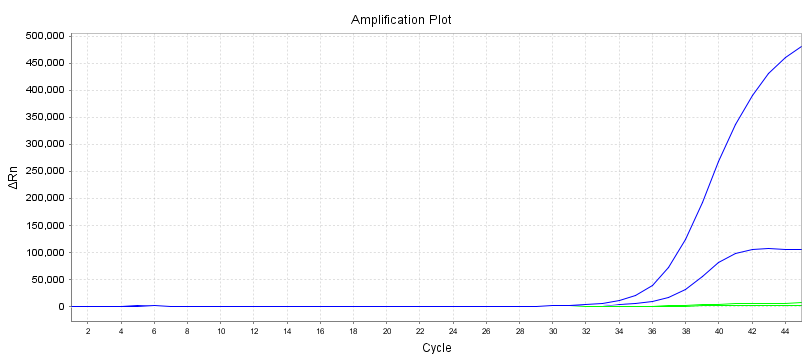
Variasjonskoeffisient (CV)
10 duplikatprøver kan påvises med forskjellige primerprober i henhold til linjestandarden til reagenset for deteksjon av nukleinsyreamplifikasjon.
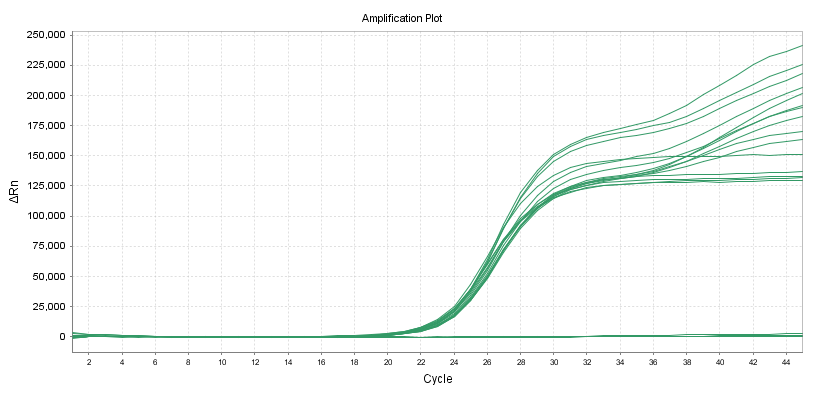
Kvantitative reagenser:
Nøyaktighet
Nøyaktigheten innenfor en batch skal oppfylle: variasjonskoeffisienten (CV,%) av den logaritmiske verdien av testkonsentrasjonen er ≤5%.Når prøvekonsentrasjonen er lav, er variasjonskoeffisienten (CV,%) av logaritmen til deteksjonskonsentrasjonen ≤10%
Kvalitative reagenser:
Nøyaktighet
Nøyaktigheten innenfor en batch skal oppfylle:
(1) Variasjonskoeffisient for Ct-verdi (CV,%) ≤5%
Den samme prøven testes parallelt i 10 ganger, og testresultatene skal være konsistente
Innleggstid: 18. september 2021








