Antistoffer, også kalt immunglobuliner (Ig), er glykoproteiner som spesifikt binder seg til antigener.
Konvensjonelle antistoffpreparater produseres ved å immunisere dyr og samle antiserum.Derfor inneholder antiserum vanligvis antistoffer mot andre urelaterte antigener og andre proteinkomponenter i serumet.Generelle antigenmolekyler inneholder stort sett flere forskjellige epitoper, så konvensjonelle antistoffer er også en blanding av antistoffer mot flere forskjellige epitoper.Selv de konvensjonelle serumantistoffene rettet mot den samme epitopen er fortsatt sammensatt av heterogene antistoffer produsert av forskjellige B-cellekloner.Derfor kalles konvensjonelle serumantistoffer også polyklonale antistoffer, eller forkortet polyklonale antistoffer.
Monoklonalt antistoff (monoklonalt antistoff) er et svært ensartet antistoff produsert av en enkelt B-celle klon og kun rettet mot en spesifikk epitop.Det er vanligvis fremstilt av hybridomteknologi - hybridomantistoffteknologi er basert på cellefusjonsteknologi, og kombinerer B-celler med evnen til å skille ut spesifikke antistoffer og myelomceller med uendelig vekstkapasitet til B-cellehybridomer.Denne hybridomcellen har egenskapene til en foreldrecelle.Det kan spre seg på ubestemt tid og udødelig in vitro som myelomceller, og det kan syntetisere og skille ut spesifikke antistoffer som miltlymfocytter.Gjennom kloning kan en monoklonal linje avledet fra en enkelt hybridomcelle, det vil si en hybridomcellelinje, oppnås.Antistoffene den produserer er svært homogene antistoffer mot samme antigene determinant, det vil si monoklonale antistoffer.
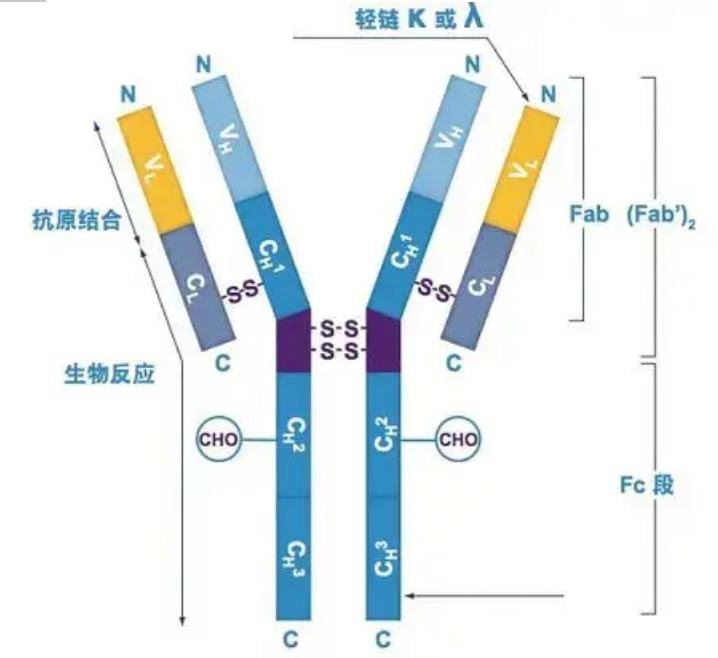
Antistoffer eksisterer som en eller flere Y-formede monomerer (dvs. monoklonale antistoffer eller polyklonale antistoffer).Hver Y-formet monomer er sammensatt av 4 polypeptidkjeder, inkludert to identiske tunge kjeder og to identiske lette kjeder.Lett kjede og tung kjede er navngitt i henhold til deres molekylvekt.Toppen av den Y-formede strukturen er den variable regionen, som er antigenbindingsstedet.(Utdrag fra Detai Bio-Monoclonal Antibody Concept)
Antistoffstruktur
 Tung kjede
Tung kjede
Det er fem typer pattedyr Ig tunge kjeder, navngitt med de greske bokstavene α, δ, ε, γ og μ.De tilsvarende antistoffene kalles IgA, IgD, IgE, IgG og IgM.Ulike tunge kjeder er forskjellige i størrelse og sammensetning.α og γ inneholder ca. 450 aminosyrer, mens μ og ε inneholder ca. 550 aminosyrer.
Hver tung kjede har to regioner: den konstante regionen og den variable regionen.Alle antistoffer av samme type har samme konstante region, men det er forskjeller mellom antistoffer av forskjellige typer.De konstante områdene til de tunge kjedene γ, α og δ er sammensatt av tre Ig-domener i tandem, med en hengselregion for å øke fleksibiliteten;de konstante områdene til de tunge kjedene μ og ε er sammensatt av 4 Ig-domener.Den variable regionen av den tunge kjeden til antistoffet produsert av forskjellige B-celler er forskjellig, men den variable regionen av antistoffet produsert av den samme B-cellen eller celleklonen er den samme, og den variable regionen til hver tungkjede er omtrent 110 aminosyrer lang., Og danner et enkelt Ig-domene.
Lett kjede
Det er bare to typer lette kjeder hos pattedyr: lambda-type og kappa-type.Hver lett kjede har to koblede domener: en konstant region og en variabel region.Lengden på den lette kjeden er omtrent 211~217 aminosyrer.De to lette kjedene i hvert antistoff er alltid de samme.For pattedyr har den lette kjeden i hvert antistoff bare én type: kappa eller lambda.Hos noen nedre virveldyr, som bruskfisk (bruskfisk) og benfisk, finnes også andre typer lette kjeder som typen iota (iota).
Fab og Fc segmenter
Fc-segmentet kan kombineres direkte med enzymer eller fluorescerende fargestoffer for å merke antistoffer.Det er den delen hvor antistoffet nagler på platen under ELISA-prosessen, og det er også den delen hvor det andre antistoffet gjenkjennes og bindes i immunutfelling, immunblotting og immunhistokjemi.Antistoffer kan hydrolyseres til to F(ab)-segmenter og ett Fc-segment av proteolytiske enzymer som papain, eller de kan brytes fra hengselregionen av pepsin og hydrolyseres til ett F(ab)2-segment og ett Fc-segment.IgG-antistofffragmenter er noen ganger svært nyttige.På grunn av mangelen på Fc-segmentet vil ikke F(ab)-segmentet utfelles med antigenet, og det vil heller ikke bli fanget opp av immunceller i in vivo-studier.På grunn av de små molekylære fragmentene og mangel på tverrbindingsfunksjon (på grunn av mangel på Fc-segment), brukes Fab-segmentet vanligvis til radiomerking i funksjonelle studier, og Fc-segmentet brukes hovedsakelig som blokkeringsmiddel i histokjemisk farging.
Variable og konstante regioner
Den variable regionen (V-regionen) er lokalisert ved 1/5 eller 1/4 (inneholder ca. 118 aminosyrerester) av H-kjeden nær N-terminalen og 1/2 (inneholder ca. 108-111 aminosyrerester) nær N-terminalen av L-kjeden.Hver V-region har en peptidring dannet av intrakjede disulfidbindinger, og hver peptidring inneholder omtrent 67 til 75 aminosyrerester.Sammensetningen og arrangementet av aminosyrer i V-regionen bestemmer antigenbindingsspesifisiteten til antistoffet.På grunn av de stadig skiftende typene og sekvensen av aminosyrer i V-regionen, kan det dannes mange typer antistoffer med forskjellige bindingsantigenspesifisiteter.V-regionene i L-kjeden og H-kjeden kalles henholdsvis VL og VH.I VL og VH har aminosyresammensetningen og sekvensen til noen lokale regioner en høyere grad av variasjon.Disse regionene kalles hypervariable regioner (HVR).Aminosyresammensetningen og arrangementet av ikke-HVR-delene i V-regionen er relativt konservative, som kalles rammeregionen.Det er tre hypervariable regioner i VL, vanligvis lokalisert ved henholdsvis aminosyrerestene 24 til 34 og 89 til 97.De tre HVR-ene til VL og VH kalles henholdsvis HVR1, HVR2 og HVR3.Forskningen og analysen av røntgenkrystalldiffraksjon viste at den hypervariable regionen faktisk er stedet hvor antistoffantigenet binder seg, så det kalles den komplementaritetsbestemmende regionen (CDR).HVR1, HVR2 og HVR3 til VL og VH kan kalles henholdsvis CDR1, CDR2 og CDR3.Generelt har CDR3 en høyere grad av hypervariabilitet.Den hypervariable regionen er også hovedstedet der de idiotypiske determinantene til Ig-molekyler eksisterer.I de fleste tilfeller spiller H-kjeden en viktigere rolle i bindingen til antigenet.
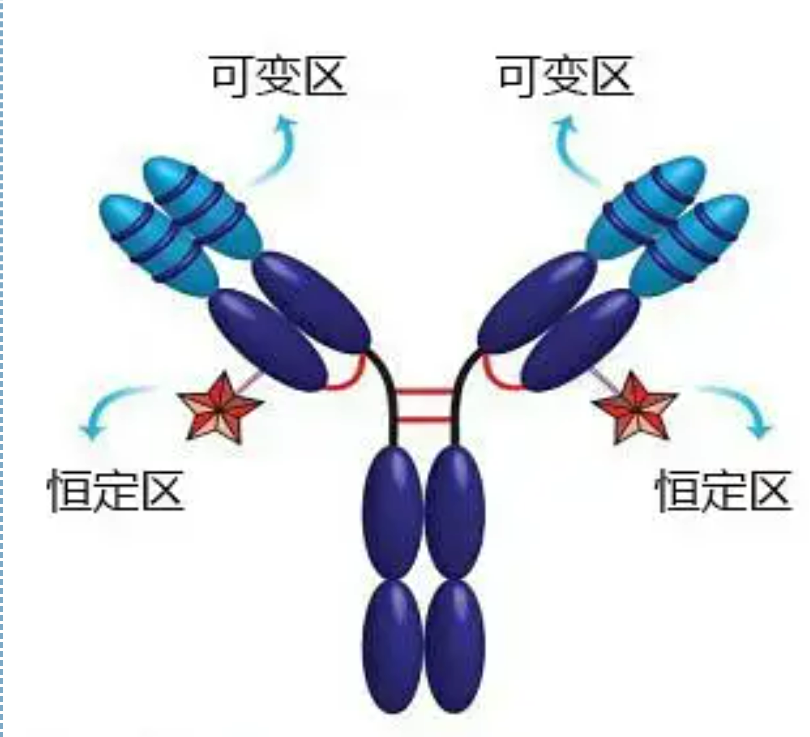 Den konstante regionen (C-regionen)er lokalisert ved 3/4 eller 4/5 (omtrent fra aminosyre 119 til C-terminalen) av H-kjeden nær C-terminalen og 1/2 (inneholder ca. 105 aminosyrerester) nær C-terminalen av L-kjeden.Hver funksjonell region av H-kjeden inneholder omtrent 110 aminosyrerester, og inneholder en peptidring sammensatt av 50-60 aminosyrerester forbundet med disulfidbindinger.Aminosyresammensetningen og arrangementet av denne regionen er relativt konstant i samme dyre-Ig-isotype L-kjede og samme type H-kjede.Det samme, det kan bare binde seg spesifikt til det tilsvarende antigenet, men strukturen til C-regionen er den samme, det vil si at den har samme antigenisitet.Hestens anti-humane IgG sekundære antistoff (eller anti-antistoff) kan kombineres med de to. En kombinasjon av antistoffer (IgG) mot forskjellige eksotoksiner oppstår.Dette er et viktig grunnlag for fremstilling av sekundære antistoffer og påføring av fluorescein, isotoper, enzymer og andre merkede antistoffer.
Den konstante regionen (C-regionen)er lokalisert ved 3/4 eller 4/5 (omtrent fra aminosyre 119 til C-terminalen) av H-kjeden nær C-terminalen og 1/2 (inneholder ca. 105 aminosyrerester) nær C-terminalen av L-kjeden.Hver funksjonell region av H-kjeden inneholder omtrent 110 aminosyrerester, og inneholder en peptidring sammensatt av 50-60 aminosyrerester forbundet med disulfidbindinger.Aminosyresammensetningen og arrangementet av denne regionen er relativt konstant i samme dyre-Ig-isotype L-kjede og samme type H-kjede.Det samme, det kan bare binde seg spesifikt til det tilsvarende antigenet, men strukturen til C-regionen er den samme, det vil si at den har samme antigenisitet.Hestens anti-humane IgG sekundære antistoff (eller anti-antistoff) kan kombineres med de to. En kombinasjon av antistoffer (IgG) mot forskjellige eksotoksiner oppstår.Dette er et viktig grunnlag for fremstilling av sekundære antistoffer og påføring av fluorescein, isotoper, enzymer og andre merkede antistoffer.
Relaterte produkter:
Cell Direct RT-qPCR-sett
Innleggstid: 30. september 2021








